珈创生物 —— 生物技术服务与研发为一体的高新技术企业
优质高效透明
High quality, efficient and transparent
发布时间:2019-08-09 10:56 信息来源: 阅读次数: 次

1101无菌检查法
无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器 械 具、原料、辅料及其他品种是否无菌的一种方法。若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响 供试品中微生物的检出。单向流空气区、工作台面及受控环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。日常检验还需对试验环境进行监测。
培养基
硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。
培养基的制备及培养条件
培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。配制后应采用验证合格的灭菌程序灭菌。制备好的培养基。若不即时使用,应置于无菌密闭容器中,在 2~25℃、避光的环境下保存,并在经验证的保存期内使用。
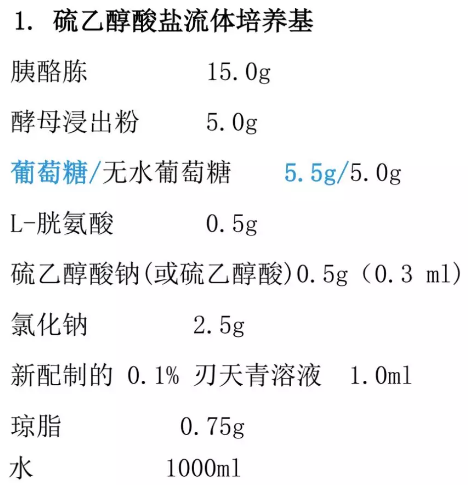
除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节 pH 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节 pH,使灭菌后在 25℃ 的 pH 值为 7.1±0.2。分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的 1/2。灭菌在供试品接种前,培养基氧化层的高度不得超过培养基深度的 1/53,否则,须经100℃ 水浴加热至粉红色消失(不超过 20 分钟),迅速冷却,只限加热一次,并防止被污染。
除另有规定外,硫乙醇酸盐流体培养基置 30~35℃培养。
2. 胰酪大豆胨液体培养基
胰酪胨 17.0g
大豆木瓜蛋白酶水解物 3.0g
葡萄糖/无水葡萄糖 2.5g/2.3g
氯化钠 5.0g
磷酸氢二钾 2.5g
水 1000ml
除葡萄糖外,取上述成分,混合,微温溶解,必要时滤过使澄清,调节 pH 使灭菌后在 25℃的 pH 值为 7.3±0.2,加入葡萄糖,分装,灭菌。
胰酪大豆胨液体培养基置 20~25℃培养。
3. 中和或灭活用培养基
按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基的处方及制法, 在培养基灭菌前或使用前加入适宜的中和剂、灭活剂或表面活性剂,其用量同方法适用性试验。
4. 胰酪大豆胨琼脂培养基
胰酪胨 15.0g
大豆木瓜蛋白酶水解物 5.0g
氯化钠 5.0g
琼脂 15.0g
水 1000ml
除琼脂外,取上述成分,混合,微温溶解,调节 pH 使灭菌后在 25℃的 pH 值为 7.3±0.2,加入琼脂,加热溶化后,摇匀,分装,灭菌。
5. 沙氏葡萄糖液体培养基
动物组织胃蛋白酶水解物和胰酪胨等量混合物 10.0g
葡萄糖 20.0g
水 1000mL
除葡萄糖外,取上述成分,混合,微温溶解,调节 pH 使灭菌后在 25℃的 pH 值为 5.6±0.2,加入葡萄糖,摇匀,分装,灭菌。
6. 沙氏葡萄糖琼脂培养基
动物组织胃蛋白酶水解物和胰酪胨等量混合物 10.0g
葡萄糖 40.0g
琼脂 15.0g
水 1000mL
除葡萄糖、琼脂外,取上述成分,混合,微温溶解,调节 pH 使灭菌后在 25℃的 pH 值为 5.6±0.2,加入琼脂,加热溶化后, 再加入葡萄糖,摇匀,分 装,灭菌。
7. 马铃薯葡萄糖琼脂培养基(PDA)
马铃薯(去皮) 200g
葡萄糖 20.0g
琼脂 14.0g
水 1000mL
取马铃薯,切成小块,加水 1000mL,煮沸 20-30 分钟,用 6-8 层纱布过 滤,取滤液补水至 1000ml,调节 pH 使灭菌后在 25℃的 pH 值为 5.6±0.2,加入琼脂,加热溶化后, 再加入葡萄糖,摇匀,分装,灭菌。
培养基的适用性检查
无菌检查用的硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基等应符合培养基的无菌性检查及灵敏度检查的要求。本检查可在供试品的无菌检查前或与供试品的无菌检查同时进行。
无菌性检查 每批培养基随机取不少于 5 支(瓶),置各培养基规定的温度培养 14 天,应无菌生长。
灵敏度检查
菌种 培养基灵敏度检查所用的菌株传代次数不得超过 5 代(从菌种保存 中心获得的干燥菌种为第 0 代),并采用适宜的菌种保藏技术进行和确认,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26003〕
铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B) 10104〕
枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63501〕
生孢梭菌(Clostridium sporogenes)〔CMCC(B) 64941〕
白色念珠菌(Candida albicans)〔CMCC(F) 98001〕
黑曲霉(Aspergillusniger) 〔CMCC(F) 98003〕
菌液制 备接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基中或胰酪大豆胨琼脂培养基上,接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35℃培养 18~24 小时;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中或沙氏葡萄糖琼脂培养 基上,20~25℃培养 2~3 天,上述培养物用 pH7.0 无菌氯化钠- 蛋白胨缓冲液或 0.9%无菌氯化钠溶液制成适宜浓度菌悬液。接种黑曲霉至沙氏葡萄糖琼脂斜面培养基或马铃薯葡萄糖琼脂培养基上,20~25℃培养 5~7 天或直到获得丰富的孢子,加入适量含 0.05%(ml/ml)聚山梨酯 80 的 pH7.0 无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯化钠溶液,将孢子洗脱。然后,采用适宜的方法吸出孢子悬液至无菌试管内,用含 0.05%(ml/ml)聚山梨酯 80 的 pH7.0 无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯化钠溶液制成适宜浓度的孢子悬液。菌悬液若在室温下放置,一般应在 2 小时内使用;若保存在 2~8℃可在 24 小时内使用。黑曲霉孢子悬液可保存在 2~8℃,在验证过的贮存期内使用。
培养基接种 取适宜装量的硫乙醇酸盐流体培养基 7 支,分别接种不大于100cfu的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌各2支, 另1支不接种作为空白对照,培养不超过3天;取适宜装量的胰酪大豆胨液体培养基 7 支,分别接种不大于 100cfu 的枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养不超过5天。
结果判定 空白对照管应无菌生长,若加菌的培养基管均生长良好,判该培养基的灵敏度检查符合规定。
稀释液、冲洗液及其制备方法
稀释液、冲洗液配制后应采用验证合格的灭菌程序灭菌。
1. 0.1%无菌蛋白胨水溶液 取蛋白胨 1.0g,加水 1000ml,微温溶解,必要时滤过使澄清,调节 pH 值至 7.1±0.2,分装,灭菌。
2. pH7.0 无菌氯化钠-蛋白胨缓冲液 取磷酸二氢钾 3.56g,无水磷酸氢二 钠 5.77g,氯化钠 4.30g,蛋白胨 1.00g,加水 1000ml,微温溶解,必要时滤过使澄清分装,灭菌。
根据供试品的特性,可选用其他经验证的适宜溶液作为稀释液、或冲洗液(如 0.9%无菌氯化钠溶液)。
如需要,可在上述稀释液或冲洗液的灭菌前或灭菌后加入表面活性剂或 中和剂等。
方法适用性试验进行产品无菌检查时,应进行方法适用性试验,以确认所采用的方法适合于该产品的无菌检查。若检验程序或产品发生变化可能影响检验结果时, 应重新进行方法适用性试验。
方法适用性试验按“供试品的无菌检查”的规定及下列要求进行操作。对每一试验菌应逐一进行方法确认。
菌种及菌液制备 金黄色葡萄球菌、枯草芽孢杆菌、生孢梭菌、白色念珠菌、黑曲霉的菌株及菌液制备同培养基灵敏度检查。大肠埃希菌(Escherichia coli )[CMCC(B) 44102]的菌液制备同金黄色葡萄球菌。
薄膜过滤法 按供试品的无菌检查要求取每种培养基规定接种的供试品总量,采用薄膜过滤法过滤,冲洗,在最后一次的冲洗液中加入 小 于不大于 100cfu 的试验菌,过滤。加至滤筒内,接种金黄色葡萄球菌、大肠埃希菌、生孢梭菌的滤筒内加硫乙醇酸盐流体培养基;接种枯草芽孢杆菌、白色念珠菌、黑曲霉的滤筒内加胰 酪大豆 胨液体培养基。另取一装有同体积培养基的容器,加入等量试验菌, 作为对照。置规定温度培养,培养时间不得超过 5 天。
直接接种法 取符合直接接种法培养基用量要求的硫乙醇酸盐流体培养基 6 管,分别接入不大于 100cfu 的金黄色葡萄球菌、大肠埃希菌、生孢梭 菌各 2 管,;取符合直接接种法培养基用量要求的胰酪大豆胨液体培养基 6 管, 分别接入不大于100cfu 的枯草芽孢杆菌、白色念珠菌、黑曲霉各 2 管。其中 1 管按供试品的无菌检查要求接入每支培养基规定的供试品接种量,另 1 管作为对照,置规定的温度培养,培养时间不得超过 5 天。
结果判断 与对照管比较,如含供试品各容器中的试验菌均生长良好,则说明供试品的该检验量在该检验条件下无抑菌作用或其抑菌作用可以忽略不计,照此检查方法和检查条件进行供试品的无菌检查。如含供试品的任一容 器中的试验菌生长微弱、缓慢或不生长,则说明供试品的该检验量在该检验条件下有抑菌作用,应采用增加冲洗量、增加培养基的用量、使用中和剂或 灭活剂、更换滤膜品种等方法,消除供试品的抑菌作用,并重新进行方法适 用性试验。
方法适用性试验也可与供试品的无菌检查同时进行。
供试品的无菌检查
无菌检查法包括薄膜过滤法和直接接种法。只要供试品性质允许,应采用薄膜过滤法。供试品无菌检查所采用的检查方法和检验条件应与方法适用性试验确认的方法相同。
无菌试验过程中,若需使用表面活性剂、灭活剂、中和剂等试剂,应证 明其有效性,且对微生物无毒性。
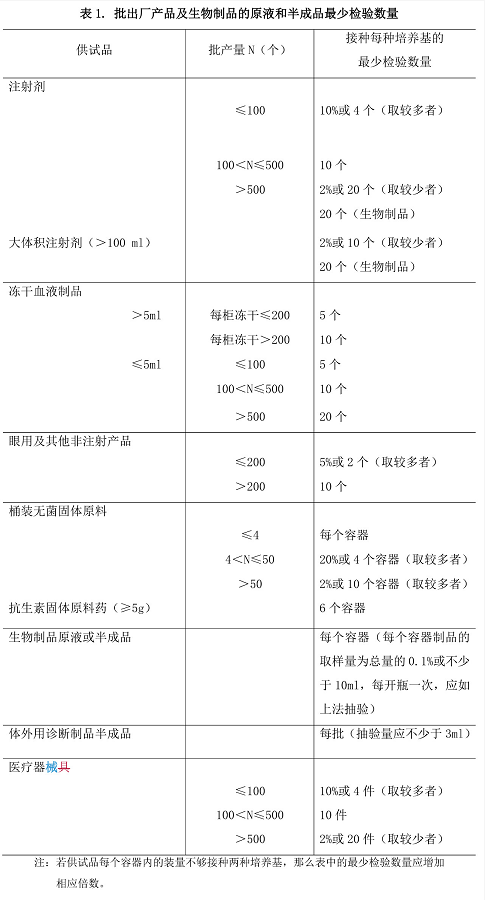
检验数量 检验数量是指一次试验所用供试品最小包装容器的数量 ,成品 每亚批均应进行无菌检查。除另有规定外,出厂产品按表 1 规定;上市产品 监督检验按表 2 规定。表 1、表 2 中最少检验数量不包括阳性对照试验的供试 品用量。
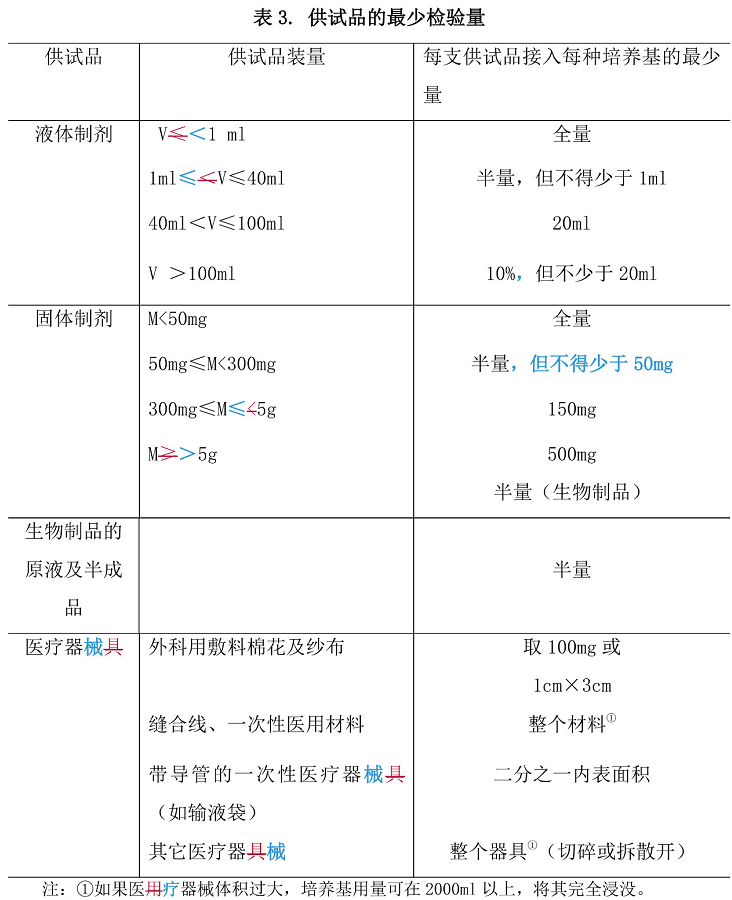
检验量 是指供试品每个最小包装接种至每份培养基的最小量(g 或 ml)。除另有规定外,供试品检验量按表 3 规定。若每支(瓶)供试品的装量按规定 足够接种两种培养基,则应分别接种硫乙醇酸盐流体培养基和胰酪大豆胨液 体培养基。采用薄膜过滤法时,只要供试品特性允许,应将所有容器内的内容物全部过滤。
阳性对照 应根据供试品特性选择阳性对照菌:无抑菌作用及抗革兰阳性 菌为主的供试品,以金黄色葡萄球菌为对照菌;抗革兰阴性菌为主的供试品, 以大肠埃希菌为对照菌;抗厌氧菌的供试品,以生孢梭菌为对照菌;抗真菌 的供试品,以白色念珠菌为对照菌。阳性对照试验的菌液制备同方法适用性 试验,加菌量不大于 100cfu,供试品用量同供试品无菌检查时每份培养 基接种的样品量。阳性对照管培养不超过 5 天,应生长良好。
阴性对照 供试品无菌检查时,应取相应溶剂和稀释液、冲洗液同法操作, 作为阴性对照。阴性对照不得有菌生长。
供试品处理及接种培养基
操作时,用适宜的方 法对供试品容器表面进行彻底消毒,如果供 试品容器内有一定的真空度,可用适宜的无菌器材(如带有除菌过滤器的针 头)向容器内导入无菌空气,再按无菌操作启开容器取出内容物。
除另有规定外,按下列方法进行供试品处理及接种培养基。
1. 薄膜过滤法
薄膜过滤法一般应采用封闭式薄膜过滤器 ,根据供试品及其溶剂的特性选择滤膜材质。无菌检查用的滤膜孔径应不大于 0.45μm。滤膜直径约为 50mm,若使用其他尺寸的滤膜,应对稀释液和冲洗液体积进行调整,并重新验证。使用时,应保证滤膜在过滤前后的完整性。
水溶性供试液过滤前,一般应先将少量的冲洗液过滤,以润湿滤膜。油类供试品,其滤膜和过滤器在使用前应充分干燥。为发挥滤膜的最大过滤效率,应注意保持供试品溶液及冲洗液覆盖整个滤膜表面。供试液经薄膜过滤后,若需要用冲洗液冲洗滤膜,每张滤膜每次冲洗量一般为 100ml,总冲洗 量一般不超过500ml,最高不得超过 1000ml,以避免滤膜上的微生物受损伤。
水溶性液体供试品取规定量,直接过滤,或混合至含不少于 100ml适宜稀释液的无菌容器中,混匀,立即过滤。如供试品具有抑菌作用,须用冲洗液冲洗滤膜,冲洗次数一般不少于三次,所用的冲洗量、冲洗方法同方 法适用性试验。除生物制品外,一般样品冲洗后,1份滤器加入 100ml 硫乙醇 酸盐流体培养基,1份滤器加入 100ml 胰酪大豆胨液体培养基。生物制品样品 冲洗后,2份滤器加入 100ml 硫乙醇酸盐流体培养基,1份滤器加入 100ml 胰酪大豆胨液体培养基。
水溶性固体和半固体供试品取规定量,加适宜的稀释液溶解或按标签说明复溶,然后照水溶性液体供试品项下的方法操作。
非水溶性供试品取规定量,直接过滤;或混合溶于适量含聚山梨酯 80或 其他适宜乳化剂的稀释液中,充分混合,立即过滤。用含 0.1%~1%聚山梨酯 80 的冲洗液冲洗滤膜至少 3 次。加入含或不含聚山梨酯 80 的培养基。接种培养基照水溶性液体供试品项下的方法操作。
可溶于十四烷酸异丙酯的膏剂和黏性油剂供试品取规定量,混合至适量 的无菌十四烷酸异丙酯中,剧烈振摇,使供试品充分溶解,如果需要可适当加热,加热温度一般不超过40℃,最高不得超过44℃,趁热迅速过滤。对仍然无法过滤的供试品,于含有适量的无菌十四烷酸异丙酯中的供试液中加入不少于 100ml 的适宜稀释液,充分振摇萃取,静置,取下层水相作 为供试液过滤。过滤后滤膜冲洗及接种培养基照非水溶性供试品项下的方法操作。
无菌气雾剂供试品取规定量,采用专用设备将供试品转移至封闭
式薄膜过滤器中。或将各容器置-20℃或其他适宜温度冷冻约 1 小时,取出,迅速消毒供试品开启部位或阀门。正置容器,用无菌钢锥或针样设备以无菌操作迅速在与容器阀门结构相匹配的适宜位置钻一小孔,不同容器钻孔大小和深度应保持基本一致,钻孔后应无明显抛射剂抛出。轻轻转动容器,使抛射剂缓缓释出。释放抛射剂后再无菌开启容器,并将供试液转移至无菌容器中混合,必要时用冲洗液冲洗容器内壁。供试品亦可采用其它适宜的方法取出。然后照水溶性液体供试品或非水溶性供试品项下的方法操作。
装有药物的注射器供试品取规定量,将注射器中的内容物(若需要可吸入稀释液或标签所示的溶剂溶解)直接过滤,或混合至含适宜稀释液的无菌容器中,然后照水溶性液体或非水溶性供试品项下方法操作。同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查。
具有导管的医疗器械(输血、输液袋等)供试品除另有规定外,取规定量,每个最小包装用适量的(通常 50~100ml)冲洗液分别冲洗内壁,收集冲洗液于无菌容器中,然后照水溶性液体供试品项下方法操作。同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查。
2. 直接接种法
直接接种法适用于无法用薄膜过滤法进行无菌检查的供试品,即取规定量供试品分别等量接种至硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中。除生物制品外,一般样品无菌检查时两种培养基接种的瓶或支数相等;生物制品无菌检查时硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基接种的瓶或支数为 2:1。除另有规定外,每个容器中培养基的用量应符合接种的供试品 体积不得大于培养基体积的 10%,同时,硫乙醇酸盐流体培养基每管装量不少于 15ml,胰酪大豆胨液体培养基每管装量不少于 10ml。供试品检查时,培养 基的用量和高度同方法适用性试验。
注:①无菌十四烷酸异丙酯的制备可采用薄膜过滤法过滤除菌,选用孔径为 0.22μm 的适宜滤膜,或其他适宜的灭菌方法。
混悬液等非澄清水溶性液体供试品 取规定量,等量接种至各管培养基中。
固体供试品取规定量,直接等量接种至各管培养基中,或加入适宜的溶剂溶解,或按标签说明复溶后,取规定量等量接种至各管培养基中。
非水溶性供试品取规定量,混合,加入适量的聚山梨酯 80 或其它适宜的乳化剂及稀释剂使其乳化,等量接种至各管培养基中。或直接等量接种至含聚山梨酯 80 或其它适宜乳化剂的各管培养基中。
敷料供试品取规定数量,以无菌操作拆开每个包装,于不同部位剪取约 100mg 或 1cm×3cm 的供试品,等量接种于各管足以浸没供试品的适量培养基中。
肠线、缝合线等供试品肠线、缝合线及其它一次性使用的医用材料按规定量取最小包装,无菌拆开包装,等量接种于各管足以浸没供试品的适量培养基中。
灭菌医用器械供试品除另有规定外,取规定量,必要时应将其拆散或切成小碎段,等量接种于各管足以浸没供试品的适量培养基中。
放射性药品取供试品 1 瓶(支),等量接种于装量为 7.5ml 的硫乙醇酸盐 流体培养基和胰酪大豆胨液体培养基中。每管接种量为 0.2ml。
培养及观察
将上述接种供试品后的培养基容器分别按各培养基规定的温度培养不少于 14 天;接种生物制品的硫乙醇酸盐流体培养基的容器应分成两等份, 一份置 30~35℃培养,一份置 20~25℃培养。培养期间应定期观察并记录是否有菌生长。如在加入供试品后或在培养过程中,培养基出现浑浊,培养 14 天后,不能从外观上判断有无微生物生长,可取该培养液不少于 1ml转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少 于4 天,观察接种的同种新鲜培养基是否再出现浑浊;或取培养液涂片,染色,镜检,判断是否有菌。
结果判断
阳性对照管应生长良好,阴性对照管不得有菌生长。若供试品管均澄清,或虽显浑浊但经确证无菌生长,判供试品符合规定;
若供试品管中任何一管显浑浊并确证有菌生长,判供试品不符合规定,除非能充分证明试验结果无效,即生长的微生物非供试品所含。当符合下列至少 一个条件时方可认为试验结果无效:
(1)无菌检查试验所用的设备及环境的微生物监控结果不符合无菌检查法的要求。
(2)回顾无菌试验过程,发现有可能引起微生物污染的因素。
(3)在阴性对照中观察到微生物生长。
(4) 供试品管中生长的微生物经鉴定后,确证是因无菌试验中所使用的物品和(或)无菌操作技术不当引起的。
试验若经确认无效,应重试。重试时,重新取同量供试品,依法检查, 若无菌生长,判供试品符合规定;若有菌生长,判供试品不符合规定。
转自:GMP办公室公众微信号